软文-CRISPR/Cas9基因编辑实验产生移码突变后为何还有蛋白表达?
CRISPR/Cas9系统是当今基因编辑和基因修饰中操作简便、效率高、成本低的热门主流基因编辑技术系统,它作为一种理想的研究基因功能的方法,可以精确地识别和定位基因组中的特定序列、或改变基因组中的目标序列以达到各种目的。
Cas9蛋白—核酸内切酶只对特定DNA单链进行切割造成DNA缺口,通过设计特定的引导RNA(single guide RNA,sgRNA)识别目的基因,使Cas9蛋白靶向相应的DNA链并与之结合形成DNA断裂(DNA strand breaks,DSB);DNA双链断裂后,通常情况下细胞会采用高效的非同源末端连接(non-homologous end joining,NHEJ)方式对断裂的DNA进行修复;细胞进行非同源重组修复过程中通常会发生碱基插入或缺失的错配现象从而造成移码突变(图1)。
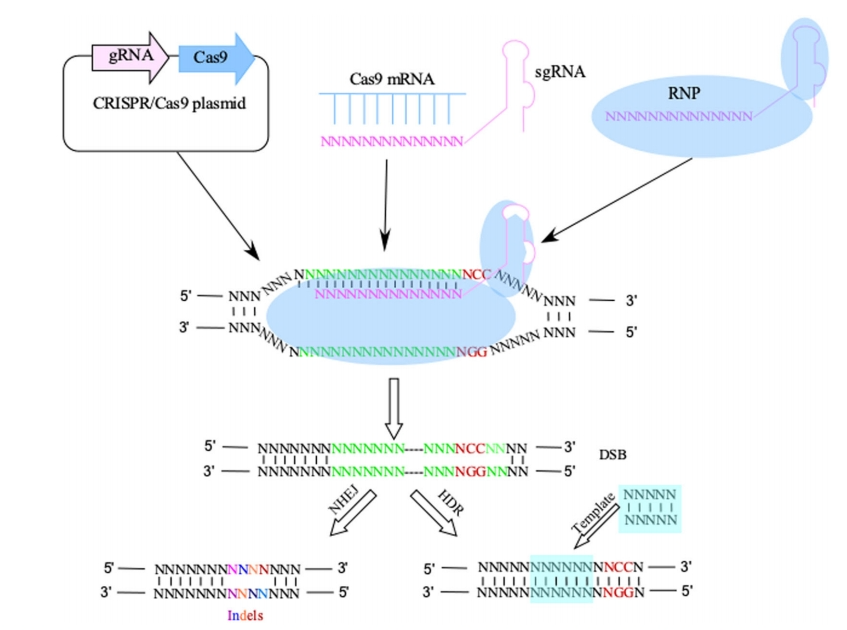
图1 CRISPR/Cas9系统图解 (Tian et al., 2019)
移码突变导致mRNA模板或翻译复合物有缺陷,新生的多肽在翻译过程中的QC事件将被激活,从而促使翻译复合物解体。无意义介导的mRNA的降解(nonsense-mediated mRNA degradation, NMD)是影响CRISPR/Cas9系统基因编辑敲除(knockout,KO)mRNA水平的主要通路(图2)。
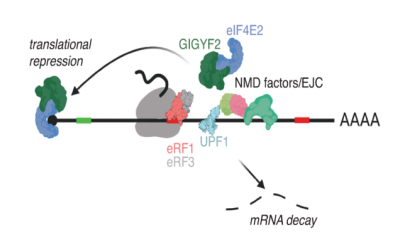
图2 NMD降解途径图解(Zinshteyn et al., 2021)
移码突变产生之后验证KO结果是必要的,DNA水平和蛋白质水平的验证显得十分关键。由图3所示,细胞系进行CRISPR/Cas9基因编辑敲除实验后的测序结果表明,KO成功细胞系相较于WT/AB野生型细胞系在sgRNA敲除位点出现了一个碱基的缺失,产生移码突变。
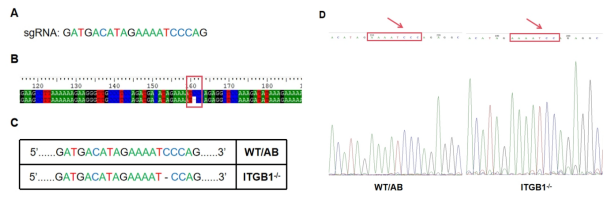
图3 单克隆细胞测序移码突变结果图
(A)sgRNA设计序列;(B, C)KO成功细胞系与WT/AB野生型
细胞系DNA序列结果对比图。(D)KO成功细胞系与WT/AB
野生型细胞系测序结果对比峰图。
DNA水平验证通常是通过测序是否产生了移码突变来确定的,蛋白水平的验证通常是通过免疫印迹分析(Western blotting,WB)实现的,当实验中移码突变产生时,我们认为基因编辑敲除是成功的,但出现移码蛋白没有消失的现象也屡见不鲜。如图4所示,与对照组相比,6泳道蛋白消失,5泳道蛋白条带仍然存在,而3泳道蛋白条带虽然存在但残留量极少。且有研究表明这种残留水平和mRNA残留无明显相关性,理想的KO实验结果为6泳道所示,但是为何会出现4、5泳道这种情况呢?在这里我们一起探讨一下为什么在基因水平上发生了移码而该基因编码的蛋白质没有或部分消失的问题。
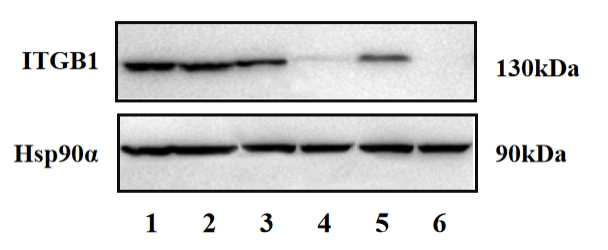
图4 单克隆细胞蛋白表达水平
1、2、3泳道为WT/AB野生型对照组ITGB1蛋白表达水平;
4、5、6泳道为发生移码突变实验组ITGB1蛋白表达水平
分析有以下几点原因:
1、抗体的特异性:非特异性条带是蛋白检测中最常见的问题,使用高质量、特异性强的抗体是获得可靠结果的关键。在实验中如果抗体的特异性不好,胶条通常会出现非特异性蛋白来干扰我们的实验结果,所以选择高特异性的抗体显得尤为重要。
2、移码突变位置:移码突变是指DNA链上出现插入或缺失1个、2个甚至多个碱基(非3个碱基或3的整数倍的碱基),导致在插入或缺失碱基部位以后的密码子顺序和组成发生相应改变从而导致氨基酸排列错误。当移码出现3个或3的整倍数碱基时,可能对氨基酸序列不产生影响;同样当移码出现一个碱基的替换时,密码子可能改变其中一个碱基,根据密码子的简并性翻译出的氨基酸并未发生变化。这两种情况均可导致蛋白的正常表达。
3.截断蛋白:由于移码突变导致密码子移位,终止密码常出现推后或提前出现,结果造成新合成的肽链延长或缩短,容易出现截断蛋白残留,对抗体的结合位点产生干扰。
4.实验操作失误:分选单克隆细胞的过程操作不当导致一个孔内不是单细胞而是2-3个细胞,其中混有野生型细胞将会导致蛋白仍然表达或低表达;或者是WB实验上样时点样操作失误,条带污染导致蛋白仍然表达。
5、遗传补偿效应:遗传补偿效应是指在某一基因发生突变彻底失去功能后,机体采用相应机制,提高其他基因的表达来代替这一基因的功能。无义突变和核苷酸序列同源性是激活遗传补偿效应的两个先决条件(Ma et al., 2019)。
6、转录本可变剪切:可变剪切指当某个外显子被破坏或缺失时,其转录的mRNA前体通过不同的剪接方式产生不同的mRNA剪接异构体的过程,是调节基因表达和产生蛋白质多样性的重要机制。
1)转录起始区域可变剪切
转录过程中发生剪切的位点在转录起始区域,导致转录起始位点并未出现在预期位置,我们设计sgRNA时常靠近CDS起始位点,结果sgRNA并未在预期转录起始位点发挥作用就会导致蛋白正常表达的情况。
2)外显子跳跃
敲除位点移码产生后可能导致内含子中的mRNA剪接规则被破坏,缺失的外显子序列在mRNA剪切阶段被略过,直接将其上游的外显子与下游的外显子相连,形成一种全新的mRNA,从而继续蛋白的翻译,导致蛋白质正常表达(Smits et al., 2019)。
因此,基因敲除实验中产生移码突变后并不能保证目的蛋白一定不表达以及该基因功能的缺失。以上数据说明,验证抗体特异性的最好方法是通过基因沉默或基因敲除的技术使该基因编码的蛋白质消失。本公司通过独有的 ShGETM基因沉默平台已经推出了500多种经过验证的慢病毒和高特异性抗体,这些生物制剂将会为生物医学基础研究和CRO临床实验提供可靠的资源和服务。
参考文献
MA, Z., ZHU, P., SHI, H., GUO, L., ZHANG, Q., CHEN, Y., CHEN, S., ZHANG, Z., PENG, J. & CHEN, J. 2019. PTC-bearing mRNA elicits a genetic compensation response via Upf3a and COMPASS components. Nature, 568, 259-263.
SMITS, A. H., ZIEBELL, F., JOBERTY, G., ZINN, N., MUELLER, W. F., CLAUDER-MüNSTER, S., EBERHARD, D., FäLTH SAVITSKI, M., GRANDI, P., JAKOB, P., MICHON, A. M., SUN, H., TESSMER, K., BüRCKSTüMMER, T., BANTSCHEFF, M., STEINMETZ, L. M., DREWES, G. & HUBER, W. 2019. Biological plasticity rescues target activity in CRISPR knock outs. Nat Methods, 16, 1087-1093.
TIAN, X., GU, T., PATEL, S., BODE, A. M., LEE, M. H. & DONG, Z. 2019. CRISPR/Cas9 - An evolving biological tool kit for cancer biology and oncology. NPJ Precis Oncol, 3, 8.
ZINSHTEYN, B., SINHA, N. K., ENAM, S. U., KOLESKE, B. & GREEN, R. 2021. Translational repression of NMD targets by GIGYF2 and EIF4E2. PLoS Genet, 17, e1009813.